1661. gadā Roberts Boils darbā «Ķīmiķis-skeptiķis» apraksta paša novēroto, ka ir divas būtiskas atšķirības: starp ķīmisko savienojumu un maisījumu, un savienojumu un elementu. Maisījums, tas ir vienkārši... nu, tas ir maisījums. Savienojums arī var veidoties samaisot, taču sadalīt to būs iespējams tikai kādā savādākā veidā: karsējot, kodinot ar skābi un tā tālāk. Ko savienojumā nevar atrast, tas ir kaut ko neviendabīgu, kā maisījumā, kaut arī jums būtu ērgļa acs vai pianista pirksti.
Elements savukārt, arī ir nedalāms, taču tāpēc, ka sastāv no viena un tā paša.
Sērs patiešām izrādās elements. Sāls, kā tagad zināms, īstenībā ir nātrija — mīksta, nedegoša metāla - un hlora — indīgas gāzes — savienojums. Ūdens sastāv no divām gāzēm — ūdeņraža un skābekļa. Gaiss ir dažādu gāzu maisījums, dažām no tām ir elementārs sastāvs (skābeklis, slāpeklis), bet citām — sarežģīts (kā ogļskābai gāzei, kas sastāv no oglekļa un skābekļa). Zeme ir ļoti sarežģīts maisījums, kuras sastāvs turklāt ir unikāls dažādās planētas malās. Uguns vispār nav viela, bet vielas pārvērtības process, kura rezultātā rodas dažādas gāzes. Pagāja visai daudz gadu, līdz 1789. gadā Antuāns Lavuazjē izveido 33 elementu sarakstu, vairums, no kuriem ir pazīstami arī mūsdienās. Zinātnieks pieļauj dažas saprotamas kļūdas, piemēram, pieskaita elementiem arī gaismu un siltumu. Taču viņa pieeja bija sistemātiska un apdomīga.
Uz šo dienu ir atklāti 112 elementi. [Vēl 6 ir novēroti, bet to jāapstiprina — t.p.] Daži ir iegūti mākslīgi; daži eksistē niecīgu sekundes daļu; taču vairums elementu var iegūt no zemes, jūras ūdens vai tieši no apkārtējā gaisa. Un, rēķinoties ar iespēju iegūt mākslīgi vēl kādus pārredzamā nākotnē, jāsaka, ka elementu saraksts pašlaik noteikti ir pilns.
Alķīmijas «māksla» nelabprāt deva ceļu ķīmijas zinātnei. Atklāto elementu skaits neapturami auga. Kaut arī brīžiem samazinājās, kad zinātnieki saprata, ka viņi par jaunu elementu ir noturējuši kādu savienojumu. Tā Lavuazjē «kaļķis» izrādās īstenībā sastāvēja no diviem elementiem — kalcija un skābekļa. Nemainīgs palika tikai sākuma pieņēmums, kuru bija atklājuši jau senie grieķi: katrs elements ir unikāls un tam piemīt tikai viņam raksturīgas īpašības.
Blīvums, vai tas istabas temperatūrā un pie normāla atmosfēras spiediena būtu — ciets ķermenis, šķidrums vai gāze; kušanas vai vārīšanās temperatūra — katram elementam šie lielumi ir noteikti un nemainīgi. Tā arī Plakanajā pasaulē, kaut arī tur ir sastopams mums neparastais helonijs (atrodas gigantisko bruņurupuču sastāvā), ziloņradis (tas pats, attiecībā uz ziloņiem) un narratīvijs, ļoti svarīgs «elements» ne vien uz Diska, bet arī uz Zemes. Narratīvija atšķirīgā pazīme - tā spēja veidot sakarīgus vēstījumus. Patiešām, cilvēka smadzenēm ļoti svarīgs elements.
Tātad, cilvēce apjauta, kāpēc elementi ir unikāli katrs savā veidā, un kā tie atšķiras no ķīmiskajiem savienojumiem. Pirmatklājēja loma atkal ir grieķu pusē, konkrēti Demokrītam, kas pirmo reizi pieņēma, ka viss sastāv no sīkām elementārdaļiņām - atomiem (grieķu vārds ar nozīmi «nedalāms»). Nav skaidrs, vai šim apgalvojumam ticēja vēl kāds, ieskaitot pašu Demokrītu, taču kā iemesls diskusijām tas kalpot varēja.
Antīkās idejas atdzimšanas veicināšanas gods pieder Boilam. Viņš izteica minējumu, ka katram elementam eksistē savs atoma veids, bet savienojumi veidojas no dažādu atomu apvienošanas. Tā, elements skābeklis sastāv tikai no skābekļa atomiem un nekā cita; ūdeņradis — tikai no ūdeņraža atomiem; bet ūdens savienojums — nekādā ziņā no ūdens atomiem, bet gan no ūdeņraža un skābekļa atomiem.
1807. gadā notiek viens no visnozīmīgākajiem notikumiem gan ķīmijas, gan arī fizikas vēsturē. Angļu zinātnieks Džons Daltons atklāja iespēju ienest kaut vai kārtības redzamību elementus sastādošo atomu daudzveidībā un tajā pašā laikā sistematizēt ķīmiskos savienojumus. Viņa priekšgājēji atzīmēja, ka vienkāršie ķermeņi reaģējot savienojas stingrās un nemainīgās proporcijās. Konkrēts daudzums skābekļa un tik pat daudz ūdeņraža dod tādu pat daudzumu ūdens, un reaģentu masu attiecība paliek nemainīga. To pašu var novērot arī citos savienojumos, kuros ir iesaistīti šie elementi.
Daltons nonāk pie viedokļa, ka atomiem vajag būt pastāvīgai masai, bet skābekļa atomam ir jāsver 16 reizes vairāk nekā ūdeņraža atomam. Pierādījumus vajadzēja meklēt aplinkus ceļos, tāpēc, ka tik mazu svaru nav iespējams izmērīt. Taču argumenti izrādās izsmeļoši un neatvairāmi. Tā zinātnē parādās «atomsvara» teorija, kas palīdz ķīmiķiem izvietot elementus to atomu masas pieaugšanas kārtībā.
Saraksta sākums izskatās šāds:
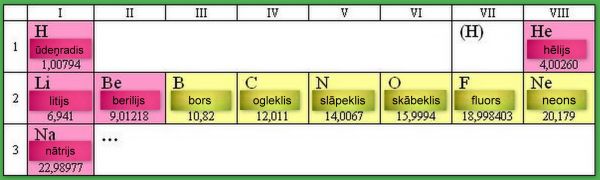
Uzmanību pievērš fakts, ka atommasu lielumi ir tuvi veseliem skaitļiem. Pirmais izņēmums no šī likuma ― hlors; tā atoma masa sastāda 35,453 g uz molu. Nav īsti saprotami, bet sākumam nav slikti: tagad rodas iespēja izpētīt citus paraugus un noteikt to atommasu. Kaut gan, viegli teikt «izpētīt», toties grūti izdarīt. Elementu saraksts nav sakārtots, gandrīz haotisks, ja runa ir par to īpašībām. Dzīvsudrabs ― vienīgais, tolaik zināmais, šķidrais (istabas temperatūrā) elements ― dzīvsudrabs ir metāls. (Vēlāk tika atklāts vēl viens, tikai viens šķidrums ― broms.) Ir vesela rinda citu metālu ― dzelzs, varš, sudrabs, zelts, cinks, alva ― visi cieti un katrs savādāks nekā pārējie; sērs un ogleklis ― cieti, bet ne metāli; daži elementi bija gāzveidīgi. Un, kad daži drosmīgie, piemēram Johans Doberainers, Aleksandrs-Emīls Begjirē de Šankurtuā, Džons Ņūlends, mēģina vismaz kaut kā organizēt šķietamo nekārtību, viņus izsmej.
Pirmais, kas piedāvāja patiešām pareizu sistēmu, bija D. I. Mendeļejevs, kas 1869. gadā pabeidza savu darbu «Elementu sistēmas mēģinājums...». Viņa tabulā iegāja 63 tolaik zināmie elementi, kas bija izvietoti atommasas pieauguma kārtībā [sakārtoti rindās un slejās — t.p.]. Bija arī tukši lauciņi — tur vajadzēja izvietot hipotētiskās, vēl neatklātās vienkāršās vielas. Periodisms izpaudās tajā apstāklī, ka elementu īpašības sāka atkārtoties pēc zināma lauciņu skaita, visbiežāk, pēc astoņiem lauciņiem.
Pēc Mendeļejeva, visi elementi iedalās grupās, kuru locekļus šķir vienu no otra periodi, par kuriem bija runa iepriekš. Katras grupas locekļu vidū vērojama fizisko un ķīmisko īpašību līdzība. Šīs īpašības arī mainās sistemātiski, virzoties pa grupu, var rast secību, kaut arī ne vienmēr precīzu. Īpaši, ja ņem vērā, ka dažu elementu tabulā trūkst — to vietā ir tukši lauciņi. Turklāt, šīs «radniecības saites» ļauj paredzēt neatklāto elementu īpašības pirms tam, kad viņi tiks atklāti. Ja gaidāmās īpašības sakrīt ar faktiskajām, atklātā elementa īpašībām — jūs esat malacis. Mendeļejeva tabulu līdz šim ir skārušas tikai nelielas izmaiņas, kopumā tā ir nesatricināma; tagad mēs to saucam par elementu periodisko sistēmu.
Tagad mēs zinām, uz kā balstās periodiskuma princips, kuru atklāja Mendeļejevs. Tas izriet no tā, ka atomi nav tik nedalāmi, kā uzskatīja Dēmokrīts un Boils. Jā, tos nav iespējams sašķelt ķīmiski, tas ir ar reakcijām mēģenē, taču to kodolus var sašķelt drīzāk fiziski. Tādas reakcijas, kuras mēs saucam par kodolreakcijām – prasa daudz vairāk enerģijas, nekā ķīmiskās, ja skaita enerģijas patēriņu uz katru atomu. Tieši tāpēc Viduslaiku alķīmiķi tā arī nespēja pārvērst svinu zeltā. Tagad to var izdarīt, taču nepieciešamās izmaksas par iekārtām pārsniegs visas saprātīgās robežas, bet dārgmetāls tiks iegūts niecīgos daudzumos un zinātnieki sāks līdzināties Plakanās pasaules zinātniekiem, kas atklāja paņēmienu, kā no zelta iegūt – mazāku daudzumu zelta.
Pateicoties fiziķu pūlēm, tagad mēs zinām, ka atomi sastāv no citām, mazākām daļiņām. Kādu laiku tika uzskatīts, ka šādas daļiņas ir tikai trīs: neitrons, protons un elektrons. Neitronam un protonam praktiski ir vienāda masa; elektrons salīdzinājumā ar tiem ir tik mazs, ka viņa masu nav vērts ņemt vērā. Neitronam nav sava elektriskā lādiņa; protonam ir pozitīvs lādiņš, bet elektronam pēc moduļa vienāds — negatīvs. Tā kā atoms kopumā lādiņu nenes, tad protonu un elektronu skaitam vajadzētu būt vienādam. Taču neitronu skaitu šis ierobežojums neskar.
Var visai precīzi noteikt elementa atoma masu, saskaitot protonu skaitu ar neitronu skaitu. Piemēram, skābeklim ir pa astoņiem protoniem un neitroniem, kas dod atoma masu 8 + 8 = 16 g/molu.
Atomi ir neiedomājami mazi pēc cilvēku mēra: tā, svina atoma šķērsgriezums ir collas viena simts miljonā daļa (centimetra 250 miljonā daļa). Taču tajā ietilpstošās daļiņas ir būtiski mazākas. Sadurot atomus vienu ar otru, fiziķi nonāca pie viedokļa, ka, pēc visa spriežot, protoni un neitroni sastāda niecīgu centrālo kodolu, bet elektroni atrodas telpā ap to. Tad arī tika izstrādāts pirmais atoma modelis, kas izskatījās pēc kādas miniatūras saules sistēmas, kur kodols ir Saule, bet elektroni — planētas. Taču šī aina neizskaidroja, piemēram, sekojošo. Elektrons ir kustīgs lādiņš, bet saskaņā ar klasisko fiziku šāds lādiņš izstaro enerģiju. Tādā veidā, saskaņā ar modeli, sekundes daļā elektronam atomā būtu jāiztērē visa enerģija un jānokrīt uz kodola. Planetārais modelis nepakļaujas fizikas likumiem, kas balstās uz Īzaka Ņutona epohālajiem atklājumiem. Tomēr, šis izplatītais mīts, meli bērniem, pārāk dziļi ir iesēdies apziņā. Tas tik pilns ar naratīviem, ka tikt no tā vaļā nav iespējams.
Pēc ilgiem strīdiem zinātnieki, kas pēta matēriju supermazos mērogos, nolēma pieņemt atoma planetāro modeli un atsacīties pievienot tam Ņūtona fiziku, nomainot to ar kvantu fiziku. Zīmīgi, ka modelis joprojām darbojās ne visai labi, taču «noturējās» pietiekoši ilgi, lai stiprinātu kvantu teorijas pozīcijas. Saskaņā ar pēdējo, protoni, neitroni un elektroni atomā neieņem noteiktu vietu telpā, bet ir it kā izsmērēti tajā. Toties, ir iespējams pateikt, cik tie ir izsmērēti: protoni un neitroni — vāji un tikai atoma centrā; elektroni atkal aizņem plašas «apkārtnes» teritorijas.
Lai kāds arī nebūtu fiziskais modelis, visi ir vienisprātis, ka atoma ķīmiskās īpašības ir atkarīgas no elektroniem, tāpēc, ka tie atrodas «ārpusē» un ķīmiskās saites būtība ir kopējie elektronu pāri.
Saistītie atomi sastāda molekulas, te arī slēpjas ķīmisko reakciju būtība. Atoms elektriski ir neitrāls, tā kā elektronu skaitam ir jābūt vienādam ar protonu skaitu. Šo skaitu sauc par atomskaitli. Nevajag to jaukt ar atoma masu, kurai pakļaujas Mendeļejeva atklātās elementu periodiskuma īpašības. Parasti atoma masa ir apmēram divas reizes lielāka par atoma skaitli, tā kā neitronu un protonu skaits ir tuvs, izejot no kvantu mehānikas pieņēmuma. Tādā veidā, jebkurš daļiņu skaits dod vienu un to pašu secību. Tomēr, atomskaitlim ir daudz lielāka ķīmiskā jēga un tas izskaidro periodisko likumu. Kā izrādās skaitlim astoņi ir liels svars un tas nav nejauši; elektroni izvietojas vairākās “kārtās”, kuras kā matrjoškas ir “ievietotas” viena otrā. Lielākajā Mendeļejeva tabulas daļā aizpildīts apvalks ietver sevī astoņus elektronus. Pēc tam apvalki palielinās un līdz ar to palielinās arī periods. Vismaz tā paziņo Džozefs Tompsons 1904. gadā. Modernā teorija – kvantu un vēl sarežģītāka – apskata daudz vairāk par trīs elementārdaļiņām, kas padara aprēķinus daudz sarežģītākus, taču slēdzieni no tā ir tādi paši. Kā visbiežāk notiek zinātnē, sākumā vienkāršs vēstījums attīstoties kļūst aizvien sarežģītāks, līdz vairums cilvēkiem sāk jau likties pēc burvestības.
Taču pat vienkāršots, šis stāsts izskaidro daudz no tā, kas liekas neaptverams. Piemēram, ja atommasa ir protonu un neitronu skaita summa, kā tā var būt skaitlis ar daļām, kā hloram (35,453 g/molu)? Izrādās ir divi hlora veidi. Vienam ir 17 protoni un 18 neitroni (un attiecīgi, 17 elektroni), tā kā atommasa ir 35. Otram — 17 protoni un 20 neitroni (kā arī 17 elektroni), kas dod atommasu 37. Hlors, kas sastopams dabā, ir šo abu izotopu (tā tos sauc) sajaukums attiecībā apmēram 3:1. Izotopus ķīmiski nevar atšķirt (nu, gandrīz nevar), tāpēc, ka tajos elektronu skaits un izvietojums ir vienāds; tādā veidā ķīmiskajās reakcijās tie iestājas vienādi. Taču no atomfizikas viedokļa tie ir visai atšķirīgi. Cilvēkam, kas stāv tālu no fizikas, ir skaidrs, kāpēc Neredzamās universitātes brīnumdari uzskata mūsu Visumu radītu uz ātru roku un no materiāliem, kas pagadījušies pa rokai...
No kurienes tad ir radušies visi šie 112 elementi? Vai tie vienmēr ir eksistējuši uz Zemes, vai arī ir izveidojušies pakāpeniski?
Mūsu Visumā elementi var rasties piecos dažādos ceļos:
- radiet Visumu ar Lielo Sprādzienu, iegūstot šādā veidā veselu augstas enerģijas («karstā») elementārdaļiņu jūrā. Pagaidiet, kamēr tā atdzisīs (vai arī izmantojiet agrāk radīto...). Bez vienkāršās matērijas jūs, iespējams, iegūsiet veselu rindu visādu dīvainību, tādu kā miniatūri melnie caurumi un magnētiskie monopoli. Taču tie ļoti ātri izzudīs un paliks tikai mums ierastā matērija. Lielā mērā. “Uzkarsētajā” visumā elektromagnētiskās mijiedarbības ir pārāk vājas, lai savienotu elementārdaļiņas, taču, kad kosmoss atdziest pietiekamā mērā, tas kļūst iespējams. Vienīgais elements, ko var iegūt tādā veidā ir ūdeņradis, kura atomā tikai viens elektrons ir saistīts ar vienu protonu [to sauc arī par protiju – t.p.]. Turklāt, ūdeņradi izdosies saražot visai daudz, jo tas Visumā ir pats izplatītākais elements un gandrīz viss tas ir radies Lielā Sprādziena rezultātā. Elementārdaļiņas var sastādīt arī deiterija atomu (viens elektrons, viens protons un viens neitrons) vai tritija atomu (viens elektrons, viens protons un divi neitroni), taču tritijs ir radioaktīvs, tātad izlaiž neitronus telpā un pārvēršas atpakaļ ūdeņradī. Daudz stabilāks ir hēlijs (divi elektroni, divi protoni un divi neitroni), tā kā tas ir otrais izplatītākais elements.
- ielaidiet gravitācijas āzi dārzā. Ūdeņradis un hēlijs savienojoties veido zvaigznes, kosmiskās «kurtuves». Zvaigznes centrā spiediens ir neizmērojami augsts. Tas ved pie jauna tipa kodolreakcijām - kodolsintēzes, kuras rezultātā atomi “salīpot” veido jaunu, lielāku atomu. Tādā veidā tika iegūti daudzi elementi: no tādiem “veciem paziņām”, kā ogleklis, slāpeklis, skābeklis, līdz retākiem: litijam, berilijam un tā tālāk līdz dzelzij. Daudzi no šiem elementiem ir sastopami dzīvajos organismos, īpaši – ogleklis. Pateicoties unikālajai elektronu apvalku uzbūvei, tikai oglekļa atomi ir spējīgi savienoties viens ar otru, veidojot gigantiskas, sarežģītas molekulas, bez kurām organiska dzīvība nav iespējama.* Jēga ir tāda: vairums atomu, no kuriem sastāv jūsu ķermenis, iespējams, ir radušies zvaigznes iekšienē. Kā Džona Mičela dziesmā Vudstokas festivālā**: «Mēs visi – zvaigžņu putekļi.» Tas ir iemīļots zinātnieku citāts: tas atgādina viņiem par jaunības dienām.
- pagaidiet, kamēr pārītis zvaigžņu uzsprāgst. Sprādzieni iedalās nelielos (nosacīti) – jauno zvaigžņu sprādzienos un spēcīgākajos, pārnovu sprādzienos. Kāpēc «jaunajos»? Vienkārši mēs reti redzam zvaigzni, kamēr tā neuzsprāgst, un tad jau mēs to noteikti redzam. Lieta šeit nav tikai tā, ka beidzas kodoldegviela: ūdaņradis un hēlijs, kas uztur zvaigzni, pārvēršas smagākos elementos, kas apgrūtina kodolreakcijas. Tā kā atkritumi moka pat zvaigznes. Fizisko izmaiņu rezultātā, kas notiek tajās, daļa protozvaigžņu uzsprāgst, radot supersmagos elementus: jodu, toriju, svinu, urānu, rādiju. Tādas zvaigznes astrofiziķi sauc par “populāciju II”; tās ir vecas un satur maz smago elementu, taču tomēr satur.
- izšķir divus pārnovu veidus; otrais tips izstrādā smagos elementus lielos daudzumos, pārvēršot zvaigzni «populācija I», kas ir daudz jaunāka par populācijas II zvaigzni***. Tā kā daudzi smagie elementi ir nestabili, daudzi citi elementi var tikt iegūti no tiem radioaktīvās dalīšanās ceļā. Tādu “sekundāro” elementu vidū, piemēram, ietilpst svins.
- beidzot, cilvēce ir iemācījusies iegūt jaunus elementus kodolreaktoros. Pats pazīstamākais no tiem ir plutonijs – parasto urāna reaktoru atkritumu sastāvdaļa un kodolieroču izgatavošanas izejviela. Vēl eksotiskākus elementus ar ļoti īsu pussabrukšanas periodu zinātnieki ir ieguvuši, triecot vienu pret otru atomus speciālās iekārtās. Pagaidām mēs esam tikuši līdz elementam ar kārtas numuru 112. Fiziķi vienmēr duelējas par to, kas pirmais ir izdarījis atklājumu un ir tiesīgs dot vārdu «jaundzimušajam», tā kā trim vissmagākajiem elementiem ir piešķirti pagaidu (un smieklīgi) vārdi, piemēram, «ununnillijs», kas sliktā latīņu valodā nozīmē «viens-viens-nulle». [Dotajā mirklī, vārdi jau ir iedoti visiem 112 elementiem, pēdējais ir kopernicijs, un vēl vismaz 6 elementi ir iegūti, taču nav apstiprināti, tiem gan ir šie dīvainie pagaidu nosaukumi – t.p.]
Kāpēc ir jāiegūst šādi nestabili elementi? Jēgas taču no tiem nav nekādas. Ko lai saka, tas ir tāpat kā ar kalniem: pietiek ar to, ka tie ir; turklāt nekad nav par vēlu pārbaudīt savu teoriju praksē. Taču parasti tas tiek darīts tāpēc, ka pēc tam var nonākt pie kaut kā interesanta, ja tikai tas patiešām eksistē. Lieta tāda, ka sākot ar poloniju (atomskaitlis 84), visi elementi ir radioaktīvi, tas ir, ne no šā, ne no tā sāk sairt un, jo lielāks numurs, jo ātrāk. Taču nestabilo elementu rinda var arī nevilkties mūžīgi. Mēs nevaram modelēt smagos atomus precīzi, tāpat kā vieglos, taču, jo tie ir smagāki, jo šāds modelis ir sarežģītāks.
Dažādi empīriski pieņēmumi (domās izdarīti spriedumi, kas balstās uz intuīciju, minēšanu un operēšanu ar piemērotu konstanšu skaitu) pašreiz ir kļuvuši par pārsteidzošu precīzu elementa stabilitātes atkarības formulu no protonu un neitronu skaita. Ja šie cipari sakrīt ar tā sauktajiem maģiskajiem — tas uzvedina uz domu, ka fiziķi ir uzsūkuši sevī Plakanās pasaules atmosfēru un ir apzinājušies, ka formula ir tuvāka buramvārdiem par jebkuru teoriju — attiecīgie atomi, nemaz necerot, ir stabili. Maģiskie skaitļi protoniem ir 28, 50, 82, 114, 164; neitroniem — 28, 50, 82, 126, 184, 196 un 318. Piemēram, svins, kurš ir pats stabilākais elements, sastāv no 82 protoniem un 126 neitroniem.
Tikai divus soļus aiz fantastiski nestabilā 112. elementa mūs gaida 114., iesākumā nosacīti nosauktais par ekasvinu. Viņam ir 114 protoni un 184 neitroni; abi šie skaitļi ir maģiskie un spriežot pēc visa tas ir daudz stabilāks par saviem tuvākajiem «kaimiņiem». Kāpēc mums nav pilnīgas pārliecības? Tāpēc, ka minētā formula tomēr ir visai aptuvena un var nenostrādāt pie tik liala elementārdaļiņu skaita. Katrs brīnumdaris zina, ka buramvārdi ne vienmēr sanāk. Taču, lai tas darbojas. Tad mēs varētu justies kā Mendeļejevi un paredzēt ekasvina īpašības, izmantojot svina apakšgrupas elementu: oglekļa, silīcija, germānija, alvas un paša svina īpašības. [Par 114. elementu ziņas var papildināt Vikipēdijā: http://en.wikipedia.org/wiki/Ununquadium un http://ru.wikipedia.org/wiki/%D0%A3%D0%BD%D1%83%D0%BD%D0%BA%D0%B2%D0%B0%D0%B4%D0%B8%D0%B9 — tur var izlasīt, ka elementam var būt izotopi, kas dzīvotu pat 11 minūtes, ļoti jau nu stabili! Pastāv zināmi argumenti, ka elements vairāk atgādina, nevis svinu, bet cēlgāzes — t.p.] Kā izriet no nosaukuma, jaunajam elementam būtu jālīdzinās svinam; iespējams, ka tas ir metāls ar kušanas temperatūru 70°С un viršanas temperatūru 150°С pie normāla atmosfēras spiediena. Tā blīvumam vajadzētu būt par 25% lielākam, nekā «vārda brālim».
Daudz tālāk atrodas «divreiz maģiskais» elements 164. ar 164 protoniem un 318 neitroniem; pēc tam maģisko skaitļu rinda var arī turpināties... Aptuveni rēķini vienmēr ir bīstami, taču pat tad, ja mūsu formula nav pareiza, noteiktam elementārdaļiņu skaitam tiešām ir jānodrošina «saimnieku» stabilitāte. Iespējams, ka no tās pašas operas ir ziloņeklis [Elephantigen] un helonijs [Chelonium]. Un nogo ar plinku jau gaida kaut kur tālumā. Iespējams, ka eksistē stabili elementi ar milzīgu atomskaitli, varbūt kāds no tiem konkurē ar zvaigznēm. Eksistē taču neitronu zvaigznes, kas pilnībā sastāv no neitroniem, kas veidojušies lielu zvaigžņu kolapsā to gravitācijas spēku dēļ. Neitronu zvaigznēm ir neiedomājams blīvums: apmēram četrdesmit triljonu mārciņu uz kvadrātcollu (100 miljardi kg/cm3), kas analogs divdesmit miljoniem ziloņu uz rieksta čaulas. Uz šo zvaigžņu virsmas pievilkšanās spēks ir septiņmiljardu reižu spēcīgāks, nekā uz Zemes, bet magnētiskais lauks – triljons reižu. Daļiņas neitronu zvaigznē ir «iepakotas» tik blīvi, ka visa zvaigzne pēc būtības ir viens liels atoms.
Lai cik neticami tas varētu likties, bet supersmagie elementi varētu slēpties Visuma tumšākajos nostūros. 1968. gadā tika izteikts minējums, ka elementi no 105. līdz 110. varētu tikt novēroti kosmiskās radiācijas staros — augstas enerģijas daļiņu plūsmās no kosmosas dzīlēm, taču tas palika bez apstiprinājuma. Uzskata, ka tādus starus var izstarot neitronu zvaigznes, tā kā, iespējams, tamlīdzīgu zvaigžņu elles liesmās varētu dzimt mūs interesējošie elementi. Bet kas notiks ar populācijas I zvaigzni, kad tā sakrās pietiekoši lielu stabilo supersmago elementu daudzumu?
Tā kā jau eksistē populācijas III, II un I — par šiem nosacītajiem apzīmējumiem astrofiziķiem vēl nāksies nožēlot — mums nāksies izdalīt hipotētisko «populāciju 0». Nākotnes Visums, visdrīzāk, saturēs jaunus, mums tagad nezināmus zvaigžņu tipus un kopā ar novu un pārnovu sprādzieniem notiks vēl jaudīgāki hipernovu sprādzieni. Nav izslēgts, ka parādīcies populācija mīnus I un tā tālāk. Kā jau tika atzīmēts agrāk, mūsu Visums bieži izstrādā savus likumus pretstatā racionālajam un noturīgajam Plakanās pasaules Visumam.
______________________
*- Šāda īpašība piemīt arī silīcijam, taču daudz mazākā mērā; ja jums noteikti ir vajadzīgas citas dzīvības formas, iedomājieties saprātīgus virpuļus, kas dzīvo saules tuvumā, noslēpumainus kvantu sakopojumus starpzvaigžņu plazmā, vai pavisam neticamus radījumus, kurus uztur tādas nemateriālas esības kā informācija, domas vai Kategoriskais Imperatīvs. DNS vienkārši izvēlēta «pēdējā»: mierīgi var derēt arī citas oglekli saturošas vielas. To apstiprina laboratorijas eksperimenti ar vienkāršotiem DNS analogiem.
** - Pajautājiet mammai vai tētim, ja neziniet, par ko ir runa.
*** - Vajag eksistēt arī populācijas III zvaigznēm, kam jābūt vecākām, nekā populācijas II zvaigznēm, un jāsastāv vienīgi no ūdeņraža un hēlija. Tad kļūst skaidrs, no kurienes populācijas II zvaigznēs atrodas daži smagie elementi. Patiesību sakot, neviens vēl nav atklājis populācijas III zvaigzni. Varbūt tāpēc, ka to mūžs ir īss. Vai, saskaņā pēc jaunākas teorijas: drīz pēc Lielā Sprādziena radās liels daudzums smago elementu — vēl pirms tam, kad veidojās pirmās zvaigznes. Tāpēc, kad tās samazināja savu blīvumu, tad iekļubva jau populācijā II. Tas gan ir pretrunā ar mūsu pašu vārdiem ārpus šīs piezīmes: tie, protams, ir tikai meli maziem bērniem.